Le malattie cardiovascolari sono la principale causa di morte nel mondo ma più del 60% dei decessi ad esse correlati potrebbe essere evitato.[1] [2] Nell’ambito delle patologie cardiovascolari, la fibrillazione atriale (AFib) è l’aritmia più comunemente diagnosticata nella pratica clinica, con una prevalenza destinata a raggiungere 15,9 milioni di persone negli Stati Uniti entro il 2050 e 17,9 milioni in Europa entro il 2060.[3]
La fibrillazione atriale si verifica quando il ritmo cardiaco è irregolare e spesso accelerato e interessa le camere superiori del cuore (atri). Il sistema elettrico del cuore controlla i tempi delle contrazioni e il modo in cui il cuore pompa il sangue al resto del corpo. Tuttavia, con un battito irregolare potrebbe venir meno la capacità del cuore di pompare correttamente il sangue nel corpo, generando coaguli che possono essere causa di un ictus. I sintomi più comuni sono le palpitazioni, l’affaticamento, la dispnea e appunto l’ictus.
Più a lungo si protrae questo ritmo irregolare, più il trattamento diventa difficile. Tuttavia se si interviene tempestivamente aumentano le possibilità di ridurre le recidive di fibrillazione atriale e di prevenirne la progressione.[4]
Un’opzione di trattamento attualmente disponibile è l’ablazione transcatetere – una procedura molto comune e minimamente invasiva eseguita da un cardiologo specializzato in elettrofisiologia. L’obiettivo di questa procedura è eliminare il battito irregolare con la cicatrizzazione del tessuto cardiaco in modo da bloccare i segnali elettrici anomali o le aritmie.
La procedura prevede piccole punture nella zona dell’inguine, del braccio o del collo e l’inserimento di tubi sottili e flessibili, detti cateteri, che vengono manovrati fino ad arrivare al cuore. L’estremità del catetere viene poi posizionata per ablare il tessuto attorno alle fonti dei segnali elettrici irregolari, spesso le vene polmonari. Il catetere utilizza quindi l’energia termica, come l’energia a radiofrequenza (calore inteso) o la crioterapia (freddo intenso) per creare una lesione del tessuto cicatriziale. Il tessuto cicatrizzato, o blocco di conduzione, impedisce ai segnali elettrici irregolari di attraversare il cuore, contribuendo a ripristinare il normale ritmo cardiaco e ad alleviare i sintomi.
Sebbene la fibrillazione atriale possa essere diagnosticata con un semplice ECG, viene spesso diagnosticata erroneamente o trattata in modo inappropriato, con una percentuale di casi non rilevati nella pratica clinica di routine che arriva al 30%.[5] I laboratori di elettrofisiologia giocano un ruolo fondamentale nella diagnosi e nel trattamento delle aritmie cardiache e richiedono sistemi di registrazione sofisticati per acquisire e analizzare accuratamente i segnali intracardiaci.
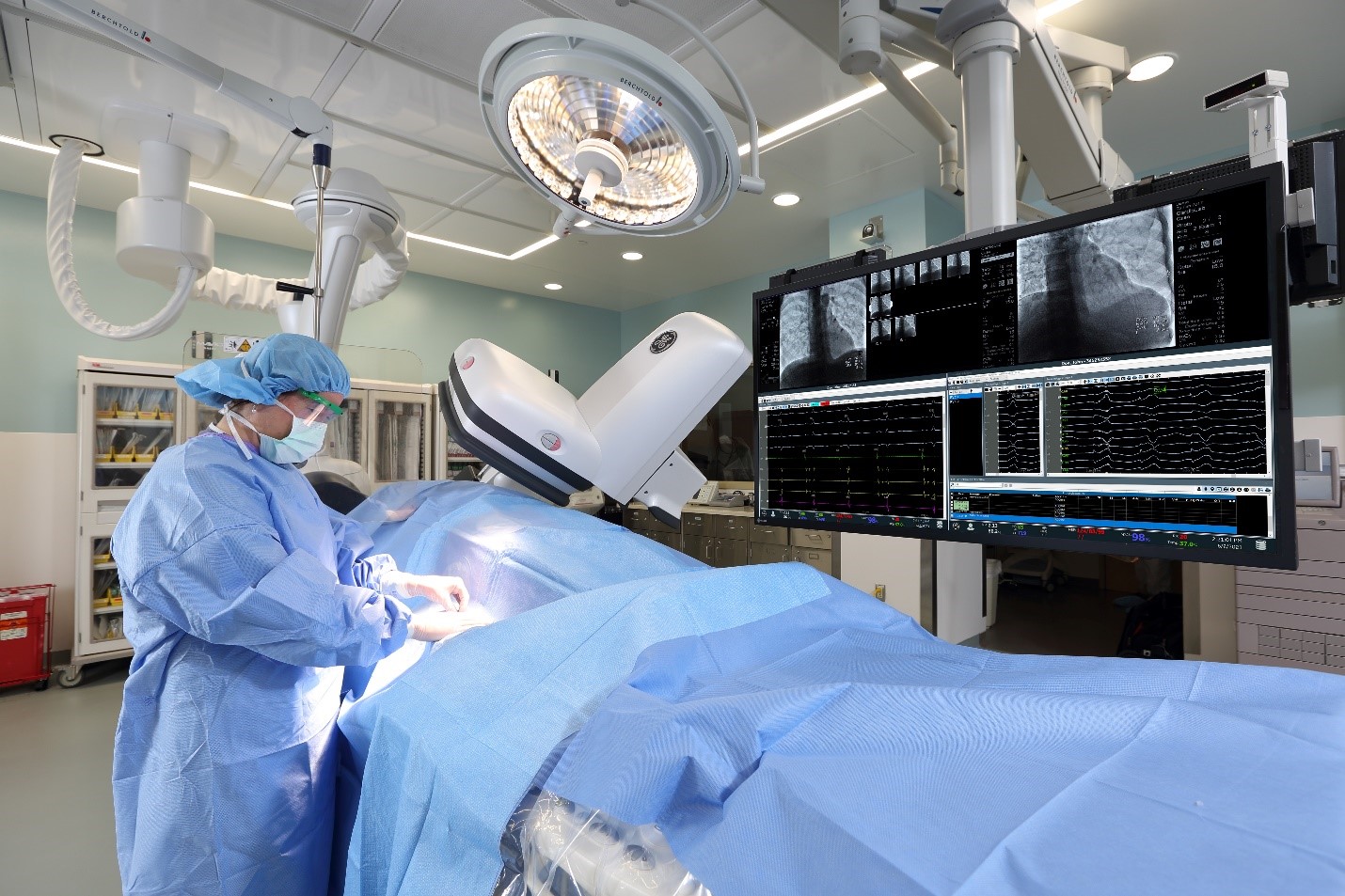
In virtù di un robusto ecosistema che comprende un’interfaccia per il mappaggio, Prucka™ 3 di GE HealthCare con il sistema di registrazione CardioLab™ EP fornisce precisione, efficienza e analisi avanzate per la diagnosi e il trattamento delle aritmie cardiache.
“I sistemi di registrazione come CardioLab di GE HealthCare sono stati determinanti per il successo delle procedure di ablazione. Con l’aggiunta di interfaccie per il mappaggio in 3D oltre 20 anni fa, la percentuale di successo dell’ablazione nel trattamento della fibrillazione atriale prossimale ha raggiunto il 90%. Tuttavia, il trattamento della fibrillazione atriale persistente di lunga durata si è rivelato più impegnativo, con percentuali di successo pari o inferiori al 50%. Questo tipo di fibrillazione atriale rappresenta una forma della malattia più avanzata – dove vi sono più punti di ablazione localizzati al di fuori delle vene polmonari e più difficili da individuare. Penso che l’IA abbia il potenziale per consentirci di fare un grande passo avanti nell’analisi del segnale – permettendoci di analizzare in modo accurato il segnale di fibrillazione atriale e di localizzare le aree di interesse – e sono impaziente di vedere se ci aiuterà a migliorare i risultati anche nel trattamento della fibrillazione atriale persistente”.
- Dr. Bahu dell’Abrazo Arizona Heart Hospital di Phoenix, Arizona.*
Vivere con la fibrillazione atriale può mettere a dura prova i pazienti, dal punto di vista fisico e mentale. L’evoluzione costante del trattamento ha permesso ai pazienti di beneficiare di una migliore qualità della vita.
*Il Dr. Bahu è consulente di GE HealthCare ed è stato retribuito per la sua partecipazione come testimonial. Le affermazioni qui riportate sono basate sulla sua esclusiva opinione e sui risultati da lui raggiunti. Poiché non esiste un “ospedale tipo” e le variabili sono molteplici (tra cui la dimensione dell'ospedale, i casi trattati, etc) non possiamo garantire che altri utenti raggiungano il medesimo risultato.
Riferimenti
1. World Health Organization (WHO) estimated 17.9 million people died from cardiovascular diseases in 2019. https://www.who.int/news-room/fact-sheets/detail/cardiovascular-diseases-(cvds)
3. Vinter N, Huang Q, Fenger-Grøn M, Frost L, Benjamin EJ, Trinquart L. Trends in excess mortality associated with atrial fibrillation over 45 years (Framingham Heart Study): community based cohort study. BMJ. 2020 Aug 11;370:m2724. doi: 10.1136/bmj.m2724. PMID: 32784208; PMCID: PMC7418071.
4. Camm A, Naccarelli G, Mittal S, et al. The Increasing Role of Rhythm Control in Patients With Atrial Fibrillation. J Am Coll Cardiol. 2022 May, 79 (19) 1932–1948. https://doi.org/10.1016/j.jacc.2022.03.337
5. January CT, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation. Circulation. 2019; 140: e125–e151. https://www.ahajournals.org/doi/full/10.1161/CIR.0000000000000665