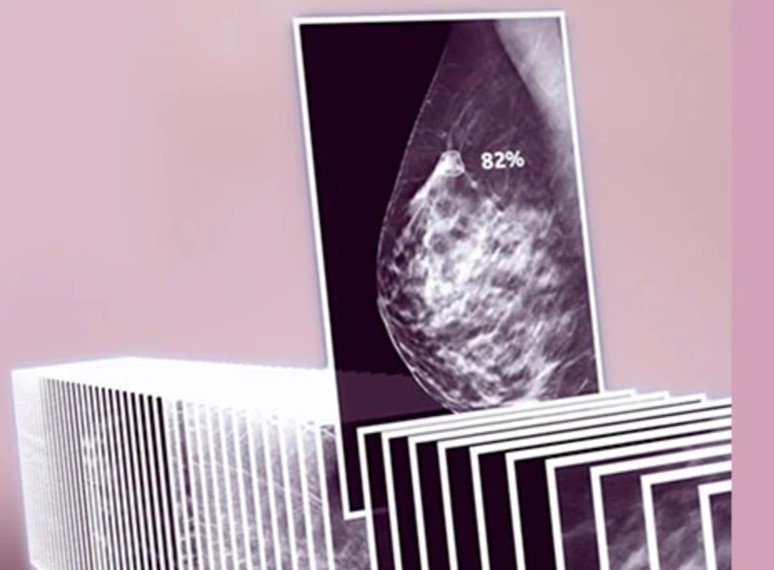
Lo screening mammografico è l'esame che viene solitamente raccomandato per la diagnosi precoce del cancro al seno. Nonostante i suoi benefici in termini di riduzione della mortalità per cancro al seno in alcuni gruppi di pazienti,[1] questo approccio potrebbe non essere adatto per tutte le donne. Ci sono infatti una serie di fattori che entrano in gioco nel determinare il rischio di sviluppare un cancro al seno, per esempio la densità del tessuto mammario o la familiarità.
Lo screening per il cancro al seno si sta evolvendo verso nuovi approcci che tengono conto dei fattori di rischio e dello stile di vita di ogni donna.
Allo stesso tempo, le disparità nell'accesso all'assistenza sanitaria e alle cure più avanzate fanno sì che ancora troppe donne muoiano di cancro al seno. Le donne afroamericane hanno, rispetto alle donne bianche, il 72% in più di probabilità di ricevere una diagnosi di carcinoma mammario invasivo, il 58% in più di probabilità di vedersi diagnosticare una malattia in stadio avanzato e il 127% in più di probabilità di morire di cancro al seno, sempre prima dei 50 anni.[2] Inoltre, per le donne che devono fare i conti con reddito e copertura assicurativa limitata, o con necessità legate all’assistenza per l’infanzia o agli spostamenti, gli esami di screening rappresentano un onere di cui non è semplice farsi carico.
Come sta evolvendo lo screening per il cancro al seno
Oggi è possibile migliorare l'accuratezza dello screening grazie alla possibilità di aggregare dati derivanti da profili genetici, analisi del sangue, fattori ambientali, storia familiare e informazioni sulla salute personale.
Partner del settore, tra cui GE HealthCare, sistemi sanitari e associazioni dei pazienti continuano a lavorare per migliorare l'accesso allo screening e per ridurre il tempo che intercorre tra lo screening, la diagnosi e il trattamento .
Aggiornamento delle linee guida per lo screening del cancro al seno
Lo screening per il cancro al seno è stato oggetto di studi randomizzati per oltre cinque decenni ed è stato raccomandato dai principali gruppi di linee guida per oltre tre decenni.[3] I moderni metodi mammografici sono stati sviluppati alla fine degli anni '60 e sono stati ufficialmente raccomandati per la prima volta dall'American Cancer Society (ACS) nel 1976. Le mammografie continuano ad essere il metodo più affidabile per lo screening per il cancro al seno.[4]
I dati sono sempre stati un fattore importante. Quelli demografici come l'età e i dati sulla popolazione vengono utilizzati per comprendere l'incidenza e la prevalenza del cancro al seno. Con questi dati, gli studi randomizzati hanno contribuito a costruire i modelli che sono la base per le linee guida sullo screening raccomandate da organizzazioni come l'ACS.
Sfortunatamente, diversi paesi hanno emanato linee guida per lo screening del cancro al seno, quindi le differenze tra le linee guida esistenti possono essere importanti.[5] Inoltre, le organizzazioni che fanno riferimento a linee guida e raccomandazioni non sono tutte d'accordo su quale sia il momento migliore per iniziare lo screening mammografico né su quale sia la frequenza ideale.
Tuttavia, le organizzazioni rilasciano regolarmente aggiornamenti alle loro linee guida, specialmente quando vengono introdotti nuovi dati o tecnologie che potrebbero avere un impatto sulle linee guida esistenti. Ad esempio, le tecnologie più recenti come la tomosintesi 3D, sono ora utilizzate nello screening del cancro al seno in molti paesi. Poiché questa tecnologia può potenzialmente sostituire i test di screening valutati in origine, le organizzazioni sanitarie e i medici necessitano di prove a sostegno della sua efficacia.
La frequenza di risultati falsi positivi dei test di screening e il problema della sovradiagnosi potrebbe portare a un cambiamento nelle raccomandazioni. Ad esempio, dati dimostrano che le donne con tessuto mammario estremamente denso hanno quasi il doppio delle probabilità di avere una mammografia falsamente positiva rispetto alle donne con tessuto adiposo.[6] Gli esperti derivano da questi dati che la sensibilità della mammografia nell'identificare il cancro al seno è ridotta per le donne con seni densi.[7]
Per le donne con tessuto mammario denso sono disponibili diversi test di screening supplementari come l'ecografia mammaria automatizzata, ma non esistono linee guida che indirizzino gli operatori sanitari verso il test di screening supplementare.[8] Un approccio più personalizzato che consideri la densità del seno della paziente può guidare strategie di screening che siano complessivamente più complete ed efficaci.
Migliorare l'accesso alle cure per ridurre i ritardi nella diagnosi e nel trattamento
Per colmare le lacune nello screening del cancro al seno dovute alle disparità di accesso sono necessarie azioni concrete. Con la sensibilizzazione e l'educazione si può fare molto. I partner del settore, i sistemi sanitari e le associazioni dei pazienti stanno contribuendo ad ampliare l’accesso allo screening per il cancro al seno con l'organizzazione di unità mobili di mammografia nelle comunità svantaggiate o il finanziamento di esami diagnostici e di screening per donne che altrimenti non potrebbero permetterseli.
Ritardi nella diagnosi e nel trattamento del cancro al seno sono stati registrati tra le sottopopolazioni di pazienti e sono associati a esiti negativi.[9],[10] Persistono disparità razziali, come riportato in uno studio che ha evidenziato come donne di colore abbiano atteso quasi 17 giorni in più per iniziare il trattamento rispetto alle donne bianche.[11]
Per ridurre questi ritardi e fornire a tutte le donne un'assistenza senologica completa, organizzazioni come GE HealthCare stanno fornendo alle cliniche consulenza, nuovi approcci ai percorsi di cura e algoritmi per implementare un percorso paziente altamente coordinato e organizzato, dall'appuntamento alla diagnosi fino al piano di trattamento. La clinica One-stop™ di GE HealthCare per la cura del seno è un approccio multimodale che permette di ottenere una diagnosi e un piano di trattamento in un'unica sede e spesso in un solo giorno. Questa soluzione mira a ridurre il tempo che intercorre tra risultati di screening anomali e una diagnosi di cancro confermata e permette di sviluppare un piano di trattamento adeguato.
Poter completare l'intera gamma di esami in un'unica giornata può fare la differenza per quelle donne che hanno difficoltà a prendersi una pausa dal lavoro o a organizzare l'assistenza all'infanzia o potrebbero non voler tornare per gli esami di follow-up dopo una mammografia sospetta.
Lo screening giusto per la paziente giusta
"Sappiamo che negli Stati Uniti circa il 40 percento delle donne ha un tessuto mammario denso", ha affermato DeLaO. “Sappiamo anche che in paesi come Cina e Giappone c'è una percentuale maggiore di donne con tessuto denso. In quelle parti del mondo, i medici possono scegliere di utilizzare l'ecografia mammaria come esame di screening alternativo.
Man mano che lo screening senologico si evolve, è possibile includere più dati per stratificare il rischio della paziente e espandere la scelta degli strumenti di screening primari in modo che i medici possano selezionare quello più efficace per le loro pazienti. Negli ultimi anni sono state introdotte più modalità di imaging come strumenti di screening supplementari per le donne con un elevato rischio di cancro al seno, comprese le donne con seno denso.[14]
La risonanza magnetica (MRI) è considerata una delle modalità di imaging più sensibili per rilevare il cancro al seno; tuttavia ha una bassa specificità, richiede l'iniezione endovenosa di gadolinio ed è associata a un tasso di falsi positivi più elevato e costi più elevati. Anche se è considerato uno strumento efficace per le donne ad alto rischio, ci sono poche prove a sostegno del ricorso alla risonanza magnetica per chi ha un tessuto mammario denso e nessun altro fattore di rischio.[15]
L'ecografia automatizzata (ABUS) è stata approvata come nuova modalità di screening supplementare dalla FDA nel 2012 e i primi studi dimostrano che l'ABUS è promettente per il rilevamento di ulteriori tumori.[16]
Il futuro dello screening per il cancro al seno e della diagnosi precoce
L'intelligenza artificiale (IA) sta avendo un profondo impatto su molte aree dell'assistenza sanitaria e l'imaging senologico non fa eccezione. Gli algoritmi di intelligenza artificiale per l'interpretazione delle mammografie stanno già migliorando l'efficacia dei programmi di screening. La capacità dell'IA di rilevare i tumori senza sovradiagnosi è la chiave per la sua adozione nella pratica clinica quotidiana.
Gli sviluppi mirano ad aggregare i dati provenienti da più fonti per migliorare l'esperienza dei pazienti. Le cartelle cliniche elettroniche contengono già dati di base provenienti da screening precedenti, tra cui informazioni sulla densità del seno, anamnesi della paziente e familiarità.
Ulteriori informazioni sulle soluzioni per la cura del seno di GE HealthCare.
Maggiori informazioni sull’assistenza senologica personalizzata.
DISCLAIMER
Non tutti i prodotti o funzionalità sono disponibili in tutti i paesi. Verificare la disponibilità con il proprio rappresentante locale GE HealthCare.
BIBLIOGRAFIA
[1] Nelson HD, Fu R, Cantor A, Pappas M, Daeges M, Humphrey L. Effectiveness of Breast Cancer Screening: Systematic Review and Meta-analysis to Update the 2009 U.S. Preventive Services Task Force Recommendation. Ann Intern Med. 2016 Feb 16;164(4):244-55. doi: 10.7326/M15-0969. Epub 2016 Jan 12. PMID: 26756588.
[2] https://www.acr.org/Practice-Management-Quality-Informatics/Imaging-3/Case-Studies/Patient-Engagement/Improving-Access-for-Women
[4] https://www.cancer.org/treatment/understanding-your-diagnosis/history-of-cancer/screening-early-detection.html
[6] Lehman CD, White E, Peacock S, Drucker MJ, Urban N. Effect of age and breast density on screening mammograms with false-positive findings. AJR Am J Roentgenol. 1999 Dec;173(6):1651-5. doi: 10.2214/ajr.173.6.10584815. PMID: 10584815.
[7] Vegunta S, Kling JM, Patel BK. Supplemental Cancer Screening for Women With Dense Breasts: Guidance for Health Care Professionals. Mayo Clin Proc. 2021 Nov;96(11):2891-2904. doi: 10.1016/j.mayocp.2021.06.001. Epub 2021 Oct 19. PMID: 34686363.
[8] Vegunta S, Kling JM, Patel BK. Supplemental Cancer Screening for Women With Dense Breasts: Guidance for Health Care Professionals. Mayo Clin Proc. 2021 Nov;96(11):2891-2904. doi: 10.1016/j.mayocp.2021.06.001. Epub 2021 Oct 19. PMID: 34686363.
[9] Bleicher RJ, Ruth K, Sigurdson ER, et al. Time to surgery and breast cancer survival in the United States. JAMA Oncol 2016;2:330-9.
[10] Gagliato DeM, Gonzalez-Angulo AM, Lei X, et al. Clinical impact of delaying initiation of adjuvant chemotherapy in patients with breast cancer. J Clin Oncol 2014;32:735-44.
[11] Selove R, Kilbourne B, Fadden MK, et al. Time from screening mammography to biopsy and from biopsy to breast cancer treatment among black and white, women Medicare beneficiaries not participating in a health maintenance organization. Women’s Health Issues 2016;26:642-7.
[13] Lee CI, Chen LE, Elmore JG. Risk-based Breast Cancer Screening: Implications of Breast Density. Med Clin North Am. 2017 Jul;101(4):725-741. doi: 10.1016/j.mcna.2017.03.005. PMID: 28577623; PMCID: PMC5458625.
[14] Lee CI, Chen LE, Elmore JG. Risk-based Breast Cancer Screening: Implications of Breast Density. Med Clin North Am. 2017 Jul;101(4):725-741. doi: 10.1016/j.mcna.2017.03.005. PMID: 28577623; PMCID: PMC5458625.
[15] Lee CI, Chen LE, Elmore JG. Risk-based Breast Cancer Screening: Implications of Breast Density. Med Clin North Am. 2017 Jul;101(4):725-741. doi: 10.1016/j.mcna.2017.03.005. PMID: 28577623; PMCID: PMC5458625.
[16] Kelly KM, Dean J, Comulada WS, Lee SJ. Breast cancer detection using automated whole breast ultrasound and mammography in radiographically dense breasts. Eur Radiol. 2010;20(3):734–742. [PMC free article] [PubMed] [Google Scholar] [Ref list]